Volume 40 - numÉro 7 - 11 octobre 2005 |
|
||
Année internationale de la physiqueLe plus petit moteur rotatif du monde!
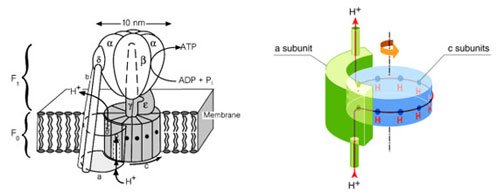
Il y a 100 ans, à l’époque où Einstein publiait sa série d’articles historiques, le modèle atomique en vogue était le modèle planétaire: tout comme les planètes autour du Soleil, les électrons tournent autour d’un noyau et forment un atome dont la majeure partie est constituée de vide. Entre l’atome et le système solaire, il n’y avait qu’un changement d’échelle! Le moteur dont il est question ici a toutes les caractéristiques d’un moulin actionné par une roue à aubes, sauf qu’il est un milliard de fois plus petit... En février 2006, le conférencier-vedette de la Biophysical Society (association américaine des biophysiciens comptant plus de 7500 membres) sera le professeur Kazuhiko Kinosita fils, du Département de physique de l’Université Waseda (Tokyo). Il nous parlera d’un moteur moléculaire qui brule de l’adénosine triphosphate (ATP) – une molécule qui fournit l’énergie nécessaire à de nombreux phénomènes cellulaires – pour «pomper» les ions d’hydrogène (c’est-à-dire des protons) à travers une membrane biologique. La beauté de ce moteur est qu’il est parfaitement réversible et sert, dans chacune de nos mitochondries, à produire l’ATP indispensable aux cellules en utilisant les différences de concentrations de protons créés à partir des éléments nutritifs que nous ingérons. Le nom de cette merveille de la nature: F0-F1 ATP synthase. Comme c’est souvent le cas dans l’étude du fonctionnement des protéines, la structure tridimensionnelle suggère un mode de fonctionnement qui peut être vérifié expérimentalement. Comme le montre le schéma, l’ATP synthase est composée de deux structures protéiques. La portion F0 est insérée dans la membrane mitochondriale et comporte une série de 12 sous-unités identiques désignées par «c». La portion F1 est appelée portion catalytique et est formée de sous-unités nommées alpha et bêta. Lorsque les deux entités sont séparées, F0 constitue un pore à protons et F1 est une «ATPase», capable de lier les molécules d’ATP et de cliver le dernier lien phosphate pour donner une molécule d’adénosine diphosphate (ADP). Un grand nombre d’études structurales ont révélé la forme de chaque sous-unité et l’arrangement proposé dans le schéma. Cet arrangement démontre clairement la présence d’un rotor comprenant le barillet d’unités «c» et l’essieu gamma qui lui est solidaire. Le stator serait constitué de la portion F1 et des sous-unités «a», «b» et delta qui lui sont directement reliées. Le mécanisme d’action suggéré est le suivant: les protons sont amenés par «a» jusqu’au centre de la membrane, où ils se lient à un site négatif présent sur chacune des sous-unités «c». Une fois neutralisée, «c» peut faire face à la membrane et entrainer la rotation du barillet et de son essieu. Cet essieu, qui est asymétrique, agit comme un arbre à cames et engendre un changement de conformation dans la sous-unité catalytique, lui permettant d’incorporer un phosphate inorganique à une molécule d’ADP et de libérer la molécule d’ATP nouvellement formée. La contribution extraordinaire de Kazuhiko Kinosita fils aura été de prouver expérimentalement que l’addition d’ATP à la sous-unité catalytique cause une rotation de l’essieu. Pour faire cette démonstration, il a posé une sous-unité catalytique et son essieu sur une lame de verre. À l’essieu, il a collé un filament d’actine fluorescent long de un micron. Ce filament peut être visualisé au microscope à fluorescence et l’on observe qu’il se met à tourner lorsque de l’ATP est ajoutée. Les sceptiques peuvent le constater de leurs propres yeux sur le site <www.k2.phys.waseda.ac.jp/index.html>. Les études récentes du professeur Kinosita visent à déterminer l’efficacité du moteur, son couple de force et sa vitesse maximale; on pense que cette dernière pourrait atteindre 8000 tours par minute! En cette ère de crise énergétique, la conférence du professeur sera peut-être une incitation à réduire la taille de nos cylindrées! Cent ans plus tard, la discipline qu’Einstein a largement contribué à définir trouve des applications inattendues. Son héritage est manifeste; la physique est en excellente santé et de plus en plus ouverte aux autres disciplines... pour le plus grand bonheur de tous! Jean-Yves Lapointe |
|||
Ce site a été optimisé pour les fureteurs Microsoft Internet Explorer, version 6.0 et ultérieures, et Netscape, version 6.0 et ultérieures.