Les travaux de recherche de Julie Perroy et Stéphanie Pontier, respectivement stagiaire postdoctorale et étudiante diplômée au Département de biochimie, feront l'objet d'une publication dans le numéro de fin d'année de la revue scientifique
Nature Methods. Ces travaux ont été effectués sous la direction du professeur Michel Bouvier, directeur du Département de biochimie et titulaire de la Chaire de recherche du Canada en signalisation cellulaire et en pharmacologie moléculaire. La Dre Muriel Aubry, professeure à ce même département, a également veillé au bon déroulement du projet.
Comme l'explique l'article, Mmes Perroy et Pontier ont démontré, en grande première mondiale, que l'observation et la mesure du processus d'ubiquitination d'une protéine donnée pouvaient s'effectuer dynamiquement, en temps réel, sur des cellules vivantes.
L'étude a été rendue possible grâce à l'utilisation de la technique BRET, mise au point au laboratoire du professeur Bouvier il y a quelques années. À la faveur de ces conclusions, il deviendra possible à l'avenir de mieux comprendre les différents rôles joués par une petite protéine à la célébrité montante, l'ubiquitine.
Prix Nobel de chimie 2004
 |
|
Michel Bouvier |
Les travaux du professeur Bouvier et de son équipe s'inscrivent en effet dans un mouvement international de recherche de pointe, alors que le prix Nobel de chimie a été décerné cette année à Aaron Ciechanover, Avram Hershko et Irwin Rose pour leurs travaux sur le rôle de l'ubiquitine dans les systèmes de dégradation des protéines. Les trois chercheurs recevront leur prix le 8 décembre prochain à l'Université de Stockholm, quelques jours à peine après la parution du dernier numéro de l'année de
Nature Methods.
L'impact majeur des travaux de recherche du professeur Bouvier et de ses collaborateurs n'a d'ailleurs pas tardé à se faire sentir et devrait croître rapidement. «Je m'attends à recevoir, dans les semaines qui vont suivre la publication, de nombreuses demandes de matériel biologique nécessaire à la mise en place de la technique BRET, confie-t-il. Comme ce fut le cas par le passé pour de précédents projets, nous allons sûrement accueillir, au sein du laboratoire, des chercheurs du monde entier venus apprendre sur place à utiliser cette technique, ce qui va entraîner des échanges intellectuels intéressants. Cela va aussi attirer de nouveaux étudiants désireux de se joindre au personnel de notre laboratoire de recherche.»
Élément non négligeable, le synchronisme entre la parution de l'article et l'annonce des Prix Nobel représente également un atout favorable à la diffusion des résultats de l'étude. «Ainsi autant les spécialistes que le public ouvert à la culture scientifique vont pouvoir découvrir l'importance de l'ubiquitine et son action dans un domaine qui nous touche tous en particulier: la santé.»
Applications médicales et pharmaceutiques
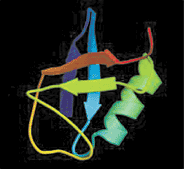 |
|
Structure cristalline de l'ubiquitine |
Depuis les dernières années, le professeur Bouvier et son équipe de recherche s'intéressent à certains récepteurs hormonaux, les récepteurs couplés aux protéines G, dont la régulation semble fortement liée à des processus d'ubiquitination. Ces récepteurs constituent l'une des cibles pharmaceutiques principales sur laquelle agissent plus de la moitié des médicaments délivrés sur ordonnance pour des maladies aussi variées que l'hypertension, les ulcères, la migraine, etc.
C'est la raison pour laquelle le professeur Bouvier participe, en collaboration avec plusieurs partenaires choisis le Département de chimie, plusieurs départements de la Faculté de médecine, la Faculté de pharmacie, l'Hôpital Sainte-Justine et le CHUM , aux travaux du Groupe de recherche universitaire sur le médicament, dont l'une des missions sera de mettre sur pied une plateforme de criblage à haut débit permettant d'identifier les composés chimiques qui présentent des activités thérapeutiques potentielles. Les études récentes sur l'observation et la mesure de l'ubiquitination en temps réel dans les cellules vivantes seront mises à profit pour tenter de mieux cibler les molécules thérapeutiques et, possiblement, en tirer de nouveaux médicaments.
Jean-François Bouchard
Collaboration spéciale
| L'ubiquitine joue un rôle de vidangeuse |
|
L'ubiquitine est une petite protéine de structure simple qu'on trouve dans toutes les cellules eucaryotes, ces cellules qui possèdent une membrane nucléaire séparant le noyau du cytoplasme. Comme son nom l'indique, il s'agit d'une protéine très répandue, présente chez la plupart des êtres vivants, des organismes les plus élémentaires aux formes de vie les plus complexes.
L'ubiquitine a tout d'abord été reconnue pour son rôle de vidangeuse dans le processus de dégradation des protéines. Au sein des cellules, les protéines ont un cycle de vie en fonction de leur utilité: elles sont synthétisées, utilisées à diverses fins, puis elles se dégradent. L'ubiquitine a pour fonction de repérer les protéines inutiles ou désuètes et de s'y attacher par un lien chimique, servant alors de marqueur qui entraîne la dégradation de la protéine ainsi «ubiquitinée».
L'ubiquitine participe aussi au système de contrôle de qualité des protéines produites à l'intérieur de la cellule. En effet, au cours de la synthèse de ces protéines, il faut être sûr que celles-ci sont formées convenablement. Le système de contrôle de qualité, qui implique plusieurs processus dont celui de l'ubiquitination, s'assure que la protéine est bien formée et bien repliée, et qu'elle va pouvoir jouer le rôle qui est le sien dans la cellule. Lorsque des protéines n'arrivent pas à se replier correctement, elles sont ciblées par l'ubiquitine, qui vient s'y fixer, indiquant au système qu'il faut s'en débarrasser.
Dérèglements de l'ubiquitination
Il existe certaines maladies associées à des dérèglements du processus d'ubiquitination, telles que des cancers et des maladies génétiques comme le syndrome de Down. Ces maladies, dites «conformationnelles», résultent du mauvais repliement des protéines lors de leur formation dans la cellule. La liste de ces maladies grandit continuellement et inclut entre autres des affections comme la rétinite pigmentaire, le diabète néphrogénique congénital, la fibrose kystique et plusieurs maladies neurodégénératives.
Deux types de dérèglements de l'ubiquitination liés aux maladies conformationnelles peuvent être observés. Dans un premier cas, le système de contrôle, censé éliminer les protéines incorrectement formées, finit par être débordé par l'ampleur de la tâche. Survient alors, dans les cellules, une agrégation de protéines mal formées dont l'accumulation toxique cause la maladie. Le second cas repose sur l'activité inverse: le contrôle de qualité, au lieu d'être débordé, fonctionne alors «trop bien». Des protéines, dont le code génétique a subi une mutation mineure, sont reconnues par le système comme étant incorrectement repliées et sont alors dégradées par ubiquitination. On a donc une perte de fonction de cette protéine qui, malgré sa mutation, aurait été fonctionnelle si elle n'avait pas été jugée inadéquate et dégradée.
En comprenant mieux les mécanismes d'action de l'ubiquitine, il sera possible de les réguler et de favoriser ou d'empêcher la dégradation de certaines protéines. Suivant cet objectif, les travaux des lauréats du prix Nobel de chimie 2004 ont d'ailleurs mené à la fabrication du premier médicament dont l'action consiste à intervenir sur le processus d'ubiquitination: le Velcade, destiné à traiter certains cancers.
Découvertes récentes des fonctions additionnelles de l'ubiquitine
Si elle a d'abord été connue pour sa fonction de vidangeuse, l'ubiquitine révèle depuis peu aux chercheurs la variété de ces rôles dans le bon fonctionnement des cellules.
On a récemment observé que l'ubiquitination, en tant que modification «post-traductionnelle» de la protéine, est utilisée pour réguler, moduler et contrôler la fonction de certaines protéines. L'ubiquitine est employée pour réguler les interactions protéines-protéines, faisant en sorte que deux protéines qui doivent interagir le font dans une plus grande ou une moindre mesure. Elle intervient également lors du déplacement des protéines, qui changent parfois de «compartiment» à l'intérieur de la cellule, selon leur activité. Ces fonctions de l'ubiquitine demeurent toutefois moins bien connues des scientifiques, mais elles ouvrent de nouvelles avenues de recherche des plus prometteuses. |